Test di laboratorio per SARS-CoV-2 e loro uso in sanità pubblica
La Direzione Generale della Prevenzione Sanitaria del Ministero della Salute ha trasmesso il documento:
“Test di laboratorio per SARS-CoV-2 e loro uso in sanità pubblica”
Il documento fornisce le indicazioni ad interim per la diagnostica di SARS-CoV-2 e i criteri di scelta dei test disponibili a seconda dei diversi contesti per un loro uso razionale e sostenibile in termini di risorse.
Alla luce delle evidenze al momento disponibili, della situazione epidemiologica e della necessità di garantire test in tempi compatibili con le diverse esigenze di salute pubblica, è fondamentale una scelta appropriata tra i test disponibili in funzione delle diverse strategie per la identificazione di infezione da SARSCoV-2.
Come riportato da altre esperienze, infatti, l’elevata sensibilità e specificità dei test non possono rappresentare l’unico criterio nella scelta del tipo di test da utilizzare nell’ambito di una strategia che prevede non solo la diagnosi clinica in un preciso momento ma anche la ripetizione del test all’interno di una attività di sorveglianza che sia sostenibile e in grado di rilevare i soggetti positivi nel loro reale periodo di contagiosità.
Quali sono i Test attualmente disponibili per scopi di sanità pubblica
Test molecolare mediante tampone
Si tratta di una indagine molecolare reverse transcription (rt)-Real Time PCR per la rilevazione del genoma (RNA) del virus SARS-CoV-2 nel campione biologico.
Questa metodica permette di identificare in modo altamente specifico e sensibile uno o più geni bersaglio del virus presenti nel campione biologico e di misurare in tempo reale la concentrazione iniziale della sequenza target. I saggi in rt-Real Time PCR, seppur con indicazioni qualitative così come descritti e suggeriti dagli organi internazionali di riferimento, permettono di ottenere una curva di amplificazione il cui Cycle Threshold o ciclo soglia (CT) è inversamente proporzionale alla quantità del bersaglio genico come stampo iniziale presente nel campione.
Quindi, in base a questo principio, maggiore è il numero delle “molecole stampo” presenti all’inizio della reazione e minore sarà il numero di cicli necessari per raggiungere un determinato valore di CT. Viceversa, un alto valore di CT, ottenuto dopo numerosi cicli di amplificazione, indica una bassa quantità di target genico iniziale e quindi di genoma virale.
La rt-Real Time PCR è il “gold standard” per la diagnosi di COVID-19. La rilevazione dell’RNA virale di SARS-CoV-2 eseguita in laboratorio da campioni clinici (in genere tamponi nasofaringei o orofaringei) ad oggi rimane il saggio di riferimento internazionale per sensibilità e specificità ed è in grado di rilevare il patogeno anche a bassa carica virale in soggetti sintomatici, pre-sintomatici o asintomatici. Per la complessità della metodica, la rilevazione di SARS-CoV-2 viene eseguita esclusivamente in laboratori specializzati con operatori esperti. Il risultato può esser ottenuto in un minimo di 3-5 ore ma situazioni organizzative e logistiche possono richiedere anche 1-2 giorni. È necessario ricordare che ai fini della segnalazione dei casi nel sistema della sorveglianza integrata COVID-19, coordinata da ISS, vengono considerati solo i risultati positivi ottenuti tramite rt-Real Time PCR dai laboratori di riferimento regionali o dai laboratori identificati/autorizzati da questi (https://www.epicentro.iss.it/coronavirus/sars-cov-2-sorveglianza). Si aggiunge la possibilità di effettuare l’analisi dei test molecolari senza effettuare l’estrazione e la purificazione dell’RNA dal campione biologico, ma di utilizzare la tecnica della inattivazione al calore (95°C/98°C) (“a crudo”). Ciò permette di semplificare, massimizzare e velocizzare il primo step dell’analisi stessa, specialmente in condizioni di forte pressione sui laboratori dovuti all’aumentare dei tamponi da processare. Il rischio di perdita di sensibilità può considerarsi minimo e presente solo ad alti numeri di cicli di amplificazione della PCR, come riportato da lavori scientifici internazionali (6-7). Tuttavia, la sensibilità risulta essere superiore al test antigenico.
Test antigenico rapido
(mediante tampone nasale, naso-oro-faringeo, salivare)
Negli ultimi mesi, sono stati sviluppati nuovi tipi di test che promettono di offrire risultati più rapidamente (30-60 minuti), con minor costo e senza la necessità di personale specializzato.
Questi sono i test antigenici rapidi, strumenti potenzialmente utili soprattutto per le indagini di screening. Analogamente ai test molecolari, i saggi antigenici sono di tipo diretto, ossia valutano direttamente la presenza del virus nel campione clinico, a differenza dei test sierologici che sono di tipo indiretto, cioè rilevano la presenza di anticorpi specifici che indicano una infezione pregressa o in atto. A differenza dei test molecolari, però, i test antigenici rilevano la presenza del virus non tramite il suo acido nucleico ma tramite le sue proteine (antigeni).
Questi test contengono come substrato anticorpi specifici in grado di legarsi agli antigeni virali di SARS-CoV-2 ed il risultato della reazione antigene-anticorpo può essere direttamente visibile a occhio nudo o letto mediante una semplice apparecchiatura al “point of care” senza la necessità di essere effettuato in un laboratorio. Negli Stati Uniti test antigenici rapidi sono stati autorizzati da FDA. In Europa, numerosi test hanno già ottenuto il marchio CE e diverse aziende di diagnostica stanno lavorando per ottenere l’approvazione normativa idonea per essere immessi sul mercato con un sufficiente grado di affidabilità.
I test antigenici sono di tipo qualitativo (sì/no) e intercettano, tramite anticorpi policlonali o monoclonali, specifici peptidi (porzioni proteiche) della proteina S (Spike) o N (nucleocapside) presenti sulla superficie virale di SARS-CoV-2.
Il test può risultare negativo se la concentrazione degli antigeni è inferiore al limite di rilevamento del test (es. se il prelievo è stato eseguito troppo precocemente rispetto all’ipotetico momento di esposizione) o se il campione è stato prelevato, trasportato o conservato impropriamente. Per questo, i produttori di tali kit evidenziano che un risultato negativo del test non esclude la possibilità di un’infezione da SARS-CoV-2 e la negatività del campione, a fronte di forte sospetto di COVID-19, dovrebbe essere confermata mediante test molecolare. I test molecolari sembrano avere una maggiore sensibilità prima della comparsa dei sintomi, mentre nella fase iniziale immediatamente successiva all’inizio dell’infezione i test rapidi antigenici e quelli molecolari hanno una sensibilità simile, rendendo utile l’uso anche dei primi. Inoltre, il test rapido antigenico può essere utilizzato per l’identificazione dei contatti asintomatici dei casi, anche se questo tipo di test non è specificamente autorizzato per questa destinazione d’uso, poiché è stato dimostrato che i casi asintomatici hanno cariche virali simili ai casi sintomatici.
Purtroppo, fino ad oggi non vi sono sufficienti studi pubblicati che, a fronte di contesti specifici e di una ampia casistica, forniscano indicazioni sulla sensibilità e specificità di questi test rapidi. Allo stato attuale, i dati disponibili dei vari test per questi parametri sono quelli dichiarati dal produttore: 70-86% per la sensibilità e 95-97% per la specificità
La Foundation for Innovative New Diagnostics (FIND) (https://www.finddx.org/covid-19/pipeline/?section=show-all#diag_tab) ha creato una piattaforma online in rapida evoluzione che raccoglie una vasta serie di saggi per SARS-CoV-2 che vanno dalle prime fasi di sviluppo fino alla piena approvazione normativa.
Riguardo i test su tampone salivare, il dispositivo di rilevazione è lo stesso, ma cambiando il campione analizzato possono cambiare le caratteristiche di sensibilità e specificità del test.
In conclusione, la sensibilità e la specificità di questi test antigenici rapidi dovranno essere valutate per i loro valori predittivi nel corso del loro sviluppo tecnologico.
È importante la condivisione dei dati a livello locale/regionale/nazionale delle validazioni su vari tipi di test antigenici rapidi, inclusi quelli salivari, in commercio nel nostro paese.
Test sierologici
I test sierologici rilevano l’esposizione al virus SARS-COV- 2 ma non sono in grado di confermare o meno una infezione in atto. Per questo, in caso di positività si necessita di un test molecolare su tampone per conferma.
Come da circolare del Ministero della Salute 16106 del 9 maggio 2020, si ribadisce che “la qualità e l’affidabilità di un test dipendono in particolare dalle due caratteristiche di specificità e sensibilità, e pertanto, sebbene non sussistano in relazione ad esse obblighi di legge, è fortemente raccomandato l’utilizzo di test del tipo CLIA e/o ELISA che abbiano una specificità non inferiore al 95% e una sensibilità non inferiore al 90%, al fine di ridurre il numero di risultati falsi positivi e falsi negativi. Al di sotto di queste soglie, l’affidabilità del risultato ottenuto non è adeguata alle finalità per cui i test vengono eseguiti”.
Rimane essenziale la rapidità di diagnosi nei soggetti con sospetto clinico e/o sintomatici e dei contatti per controllare il focolaio limitando la diffusione del virus avvalendosi di quarantena e isolamento.
Appaiono quindi importanti per la valutazione della scelta del test da utilizzare diversi parametri come, ad esempio:
- i tempi di esecuzione del test (alcune ore per i test molecolari, contro i 15-30 minuti di un test antigenico rapido ad esempio);
- la necessità di personale specializzato e di strumentazione dedicata disponibile solo in laboratorio vs. piccole strumentazioni portatili da utilizzare ovunque;
- i costi da affrontare per una politica basata sulla ripetizione dei test; il trasporto dei campioni vs l’esecuzione in loco;
- l’accettabilità del test da parte dei soggetti per l’invasività del test; la facilità di raccolta del campione; l’addestramento necessario a raccogliere/processare i campioni;
la disponibilità dei reagenti; la stabilità dei campioni.
Critica è anche la raccolta dati relativamente ai test eseguiti con la conseguente possibilità di analisi e valutazione delle strategie adottate piuttosto che della diffusione della infezione
Tabella sinottica dei test nei principali contesti
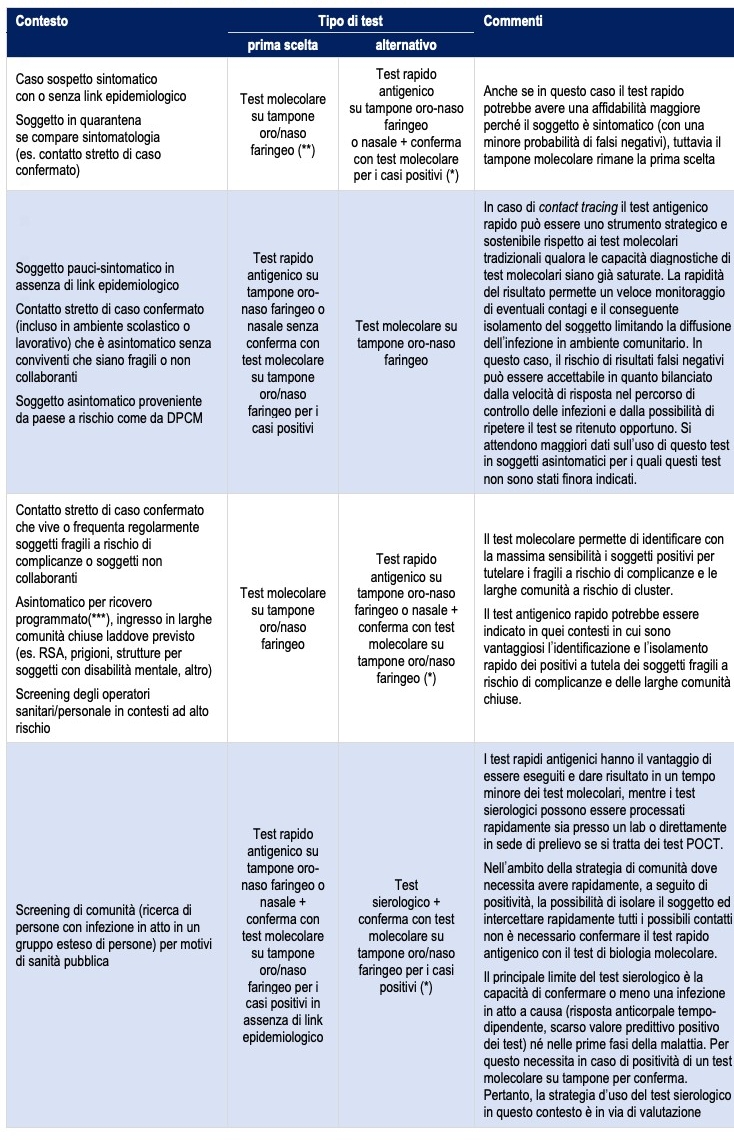
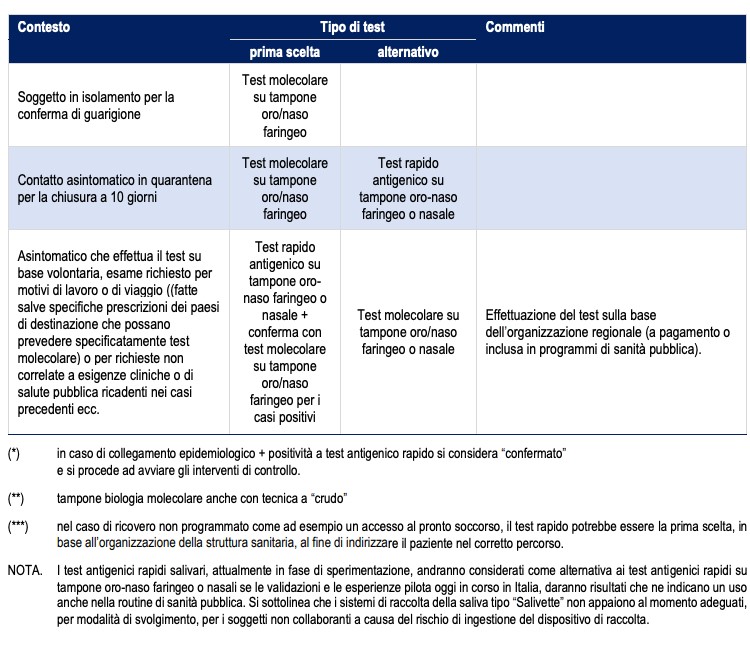
fonte: Ministero della Salute; Istituto Superiore di Sanità; INAIL; Comitato Tecnico Scientifico; Conferenza delle Regioni e delle Provincie Autonome; Consiglio Superiore di Sanità; FNOMCeO; INMI Lazzaro Spallanzani; Organizzazione Mondiale della Sanità